Teil B: Wasserversorgung und Futterhygiene
Autoren
Eine Information des DLG-Arbeitskreises Futter und Fütterung
- Herbert Nehf, BayWa, München
- Carsten Pohl, Bio Eichenmühle, Stavenhagen/Basepohl
- Georg Riewenherm, Deutsche Tiernahrung Cremer, Düsseldorf
- Dr. Gerhard Stalljohann, Landwirtschaftskammer Nordrhein-Westfalen, Bad Sassendorf
- Dr. Detlef Kampf, DLG e.V., Frankfurt am Main
2. Wasserversorgung
2.1 Wasserqualität und -aufnahme beachten – Mikrobiologie und chemische Zusammensetzung checken!
2.2 Biofilm in Wasserleitungen systematisch vorbeugen
3. Futter- und Fütterungshygiene
3.1 Unerwünschte Mikroorganismen
3.2 Beurteilung der mikrobiologisch-hygienischen Beschaffenheit von Futtermitteln
3.3 Empfehlungen zur Konservierung von Getreide
3.4 Empfehlungen zur Konservierung von Mais
3.5 Behandlung und Fermentation
3.6 Haltbarkeit von fertigen Mischungen
1. Einleitung
Dieses Merkblatt stellt den zweiten Teil B des DLG-Merkblattes 463 „Fütterung und Tierwohl beim Schwein“ dar. Der erste Teil A behandelt die Bereiche Futter, Fütterung und Faserstoffversorgung, das vorliegende Merkblatt fokussiert auf die Wasserversorgung und Futterhygiene (DLG, 2021).
Tränkwasser ist grundsätzlich als das wichtigste Futtermittel anzusehen und muss dem Nutztier vor dem Hintergrund des Tierwohls stets in ausreichender Menge und hochwertiger Qualität angeboten werden. Neben der Schmackhaftigkeit müssen die Verträglichkeit und die technische Verwendbarkeit des Wassers zur Absicherung der Gesundheit der Tiere und der Unbedenklichkeit der Lebensmittel aus tierischer Herkunft beachtet werden.
Hinsichtlich der Qualität der Futtermittel muss neben den Gehalten an Haupt- und Mikronährstoffen ein wesentlicher Blick auf die hygienische Beschaffenheit gelegt werden, da hierdurch ein wichtiger Beitrag zur Gesunderhaltung der Tiere und auch zur Absicherung der Qualität der Lebensmittel geleistet wird.
2. Wasserversorgung
Mit einer guten Wasserverfügbarkeit und Wasserqualität fängt alles an …
Ein Tier sollte pro Tag mindestens die doppelte Menge an Wasser im Vergleich zum Futter (bezogen auf 88 % Trockenmasse, TM) bei normalen äußeren Klimabedingungen aufnehmen. Unter dem Einfluss von Hitzestress kann sich in Abhängigkeit der Haltungsbedingungen der Wasserbedarf stark erhöhen. Bei einem Temperaturanstieg um 7 °C (z. B. von 20 auf 27 °C) kann der Wasserverbrauch um bis zu 20 % ansteigen. Als Faustregel gilt, dass ein Grad Temperaturanstieg über 20 °C zu einem 2 % höherem Wasserverbrauch führen kann, bei über 25 °C muss sogar von einem Anstieg um jeweils 3 % ausgegangen werden. In diesen Situationen trägt die optimale Wasserverfügbarkeit sehr stark zum Tierwohl bei und die Nichtbeachtung widerspricht dem Tierwohlgedanken (Cole et al., 1993)!
Bei einer zu geringen Wasserverfügbarkeit bei z. B. verschmutzten oder fehlenden Tränkemöglichkeiten führen auftretende Konkurrenzsituationen zu aggressivem Verhalten. Neben der Wassermenge bzw. der Wasseraufnahme ist die Wasserqualität maßgebend, Vitalität, Leistungsfähigkeit und damit auch das Verhalten der Schweine zu verbessern (Kamphues et al., 2007).
Wasser ist an einer Vielzahl von Prozessen im Körper wie den Verdauungs- und Stoffwechselprozessen beteiligt und gilt als Transportmedium für Vitamine, Mineralien und Aminosäuren und andere Stoffwechselmetabolite. Tabelle 1 zeigt den Wasserbedarf sowie die empfohlenen Durchflussmengen von Tränken für Schweine, damit die Schweine tiergerecht und ausreichend Wasser aufnehmen können.
Tabelle 1: Empfehlungen zur Wasserversorgung von Schweinen und Durchflussmenge in Abhängigkeit von Lebendmasse und Nutzung (DLG, 2008)
| Haltungsabschnitt | Lebendmasse kg | Wasserbedarf l/Tier und Tag | Durchflussmenge l/min |
| Saugferkel | < 9 | 0,7 – 1 | 0,4 – 0,5 |
| Absetzferkel | < 29 | 1 – 3 | 0,5 – 0,7 |
| Mastschweine | < 50 | 3 – 6 | 0,6 – 1,0 |
| 50 – 80 | 5 – 8,5 | 0,8 – 1,2 | |
| 80-120 | 8,5 – 11 | 1,5 – 1,8 | |
| güste und niedertragende Sauen | 8 – 12 | 1,5 – 1,8 | |
| hochtragende Sauen | 10 – 15 | 1,5 – 1,8 | |
| säugende Sauen | 15 + 1,5/Ferkel | 2,5 – 3,0 | |
| Eber | 12 – 15 | 1,0 – 1,5 |
2.1 Wasserqualität und -aufnahme beachten – Mikrobiologie und chemische Zusammensetzung checken!
Mangelnde Wasserqualitäten führen zu stark reduzierter Wasser- aber auch Futteraufnahme und damit zu einer Beeinträchtigung der Leistung und des Tierwohls. Ein regelmäßiger Wassercheck von der Quelle bis zur Tränke ist mindestens einmal jährlich zwingend erforderlich. In den Tabellen 2 und 3 sind einige wesentliche Beurteilungswerte für Tränkwasser aufgeführt.
Neben den bereits in Tabelle 1 aufgeführten Hinweisen soll die geschmackliche Beeinträchtigung des Tränkwassers vor allem durch hohe Konzentrationen an Eisen aber auch an Mangan noch einmal hervorgehoben werden. In Vorbereitung der Beurteilung der Tränkwasserqualität sind auch die Hinweise einzelner Untersuchungseinrichtungen, z. B. LUFA Nord-West oder LUFA Nordrhein-Westfalen, zur Probenahme zu beachten.
Tabelle 2: Allgemeine Beurteilungswerte für physiko-chemische Parameter in Anlehnung an den Orientierungsrahmen des BMEL zur futtermittelrechtlichen Beurteilung der hygienischen Qualität von Tränkwasser (BMEL, 2019)
| Parameter | Einheit | Orientierungswert für die Eignung von Tränkwasser | Bemerkungen (mögliche Störungen) | Grenzwert für Trinkwasser nach Trinkwasserverordnung |
| Physiko-chemische Parameter | ||||
| pH-Wert1) | > 5, < 9 | Korrosion im Leitungssystem | 6,5 – 9,5 | |
| Elektrische Leitfähigkeit, bei 25 °C | µS/cm | < 3.000 | evtl. Durchfälle bei höheren Werten, Schmackhaftigkeit | 2500 |
| Lösliche Salze, gesamt | g/l | < 2,5 | ||
| Oxidierbarkeit2) | mg/l | < 15 | Maß für Belastung mit oxidierbaren Stoffen | 5 |
| Chemische Parameter | ||||
| Ammonium (NH4+) | mg/l | < 3 | Hinweis auf Verunreinigung | 0,5 |
| Arsen (As) | mg/l | < 0,05 | Gesundheitsstörungen, Minderleistungen | 0,01 |
| Blei (Pb) | mg/l | < 0,1 | 0,01 | |
| Cadmium (Cd) | mg/l | < 0,02 | 0,003 | |
| Calcium (Ca)3) | mg/l | 500 | Funktionsstörungen, Kalkablagerungen in Rohren und Ventilen | kein Grenzwert vorhanden |
| Chlorid (Cl–) | mg/l | < 250a) < 500b) | Feuchte Exkrementea) | 250 |
| Eisen (Fe)3) | mg/l | < 3 | Antagonist zu anderen Spurenelementen, Eisenablagerungen in Rohren, Biofilmbildung, Geschmacksbeeinflussung | 0,2 |
| Fluor (F) | mg/l | < 1,5 | Störungen an Zähnen und Knochen | 1,5 |
| Kalium (K) | mg/l | < 250a) < 500b) | Feuchte Exkrementea) | kein Grenzwert vorhanden |
| Kupfer (Cu)4) | mg/l | < 2 | Gesamtaufnahme bei Schafen und Kälbern berücksichtigen | 2 |
| Mangan (Mn) | mg/l | < 4 | Ausfällungen im Verteilersystem, Biofilme möglich | 0,05 |
| Natrium (Na) | mg/l | < 250a) < 500b) | Feuchte Exkrementea) | 200 |
| Nitrat (NO3–) | mg/l | < 300c) < 200d) | Risiken für Methämoglobinbildung, Gesamtaufnahme berücksichtigen | 50 |
| Nitrit (NO2–) | mg/l | < 30 | 0,5 | |
| Quecksilber (Hg) | mg/l | < 0,003 | Allgemeine Störungen | 0,001 |
| Sulfat (SO42–) | mg/l | < 500 | Abführender Effekt | 240 |
| Zink (Zn)5) | mg/l | < 5 | kein Grenzwert vorhanden | |
1) pH < 5: sauer und möglicherweise korrosiv wirkend, Zusatz organischer Säuren kann pH-Wert senken
2) Maß für organische Substanzen im Wasser (< 5 mg/l für eingespeistes Wasser)
3) Zusetzen von Leitungen und Nippeltränken
4) Orientierungswert problematisch für Schafe sowie Kälber mit Milchaustauscher (Cu-arme Milchaustauscher verwenden)
5) Orientierungswert nur bei Herstellung von Milchaustauscher-Tränke
a) Geflügel, b) sonstige Tierarten, c) ruminierende Wiederkäuer, d) Kälber und andere Tierarten
Tabelle 3: Beurteilungswerte für mikrobiologische Parameter in Anlehnung an den Orientierungsrahmen des BMELV zur futtermittelrechtlichen Beurteilung der hygienischen Qualität von Tränkwasser (BMELV, 2007)
| Parameter | Einheit | Orientierungswert für die Eignung von Tränkwasser |
| Aerobe Gesamtkeimzahl bei 20 °C bei 37 °C | KBE/ml KBE/ml | < 10.000 < 1.000 |
| Salmonellen Campylobacter E. coli | je 100 ml je 100 ml je 100 ml | 0 0 möglichst weitgehend frei von E. coli |
KBE = kolonienbildende Einheiten

2.2 Biofilm in Wasserleitungen systematisch vorbeugen
Durch ausgeprägte Biofilme (Abbildung 1) kann es zu geschmacklichen Veränderungen des Tränkwassers kommen, wodurch die Tiere weniger Wasser zu sich nehmen. Neben dem Einfluss auf die Gewichtszunahmen kann verunreinigtes Tränkwasser das Risiko einer übergreifenden Infektion mit pathogenen Keimen steigern und Unruhen verursachen. Der Biofilm kann ferner auch die Wirkung dem Tränkwasser zugesetzter Vitamine, Ergänzungsfuttermittel, Impfstoffe und Antibiotika verringern, da er einen Teil dieser Zusätze in ihren Wirkungen einschränken kann. Weiterhin dienen diese Zusätze oft auch als Nahrung für die Mikroorganismen in der Wasserleitung, wodurch ein Keimwachstum nochmals begünstigt wird. Ebenso tragen eine hohe Stalltemperatur, eine geringe Fließgeschwindigkeit und vor allem Standwasser, insbesondere in Stichleitungen, zur Vermehrung bei. Deshalb sollten vor jeder Neubelegung alle Nippel ausreichend gespült werden, bis das Standwasser sicher entfernt ist.
Tränkwasserversorgung checken und optimieren – Ursachen für schlechte Tränkwasserhygiene beseitigen!
- Wasseruhren für jedes Abteil nutzen/verwenden!
- Tränken und Tränkwasserangebot täglich kontrollieren!
- Tränkwasserqualität mindestens einmal pro Jahr untersuchen!
- Möglichst keine Wasservorratsbehälter in Stallabteilen (Bakterienvermehrung), lichtundurchlässige Behälter einsetzen!
- Zusätzlich bei Umstallung ins Aufzuchtabteil Schalen mit einwandfreiem Wasser anbieten (gründliche Reinigung morgens und abends)!
- Vor jeder Neubelegung sollte das „alte“ Standwasser aus den Leitungen gelassen werden und Tröge reinigen!
- Kunststoff- anstelle von Metallleitungen einsetzen, keine „toten“ Leitungsstränge!
- Zentralfilter für einen Stall einbauen, keine Siebchen in den Tränkenippeln!
- Reinigung und Desinfektion von Wasserleitungen (Biofilmbeseitigung) und des Tränkwassers! (z. B. Chlordioxid, Wasserstoffperoxid)
- Bei überhöhten Eisen- bzw. Calciumgehalten im Brunnenwasser Techniken zur Enteisenung bzw. Entkalkung nutzen oder Anschluss an das öffentliche Netz!
- Alte, poröse und ablagerungshaltige Wasserleitungen insbesondere Metallrohre austauschen!
- Bei Einsatz von Beckentränken regelmäßige Reinigung vornehmen!
- Frostsicherheit gewährleisten!
- Bei der Trinkwasserversorgung aus eigenem Brunnen den Eintrag reaktiver Stickstoffverbindungen aus der Oberfläche verhindern
(Quelle: modifiziert nach Stalljohann et al., 2020)
Der Wasserverbrauch des Schweins hängt auch vom Bedarf für die Thermoregulation ab, d. h. dass Schweine bei hohen Temperaturen, also bei Hitzestress, entsprechende Verhaltensreaktionen zeigen, indem sie sich beispielsweise unter die Tränke setzen oder legen, weil der Boden dort feuchter und kühler ist bzw. das von oben nachtropfende Wasser zu einer Kühlung führt (KTBL, 2009). Diese Art der Thermoregulation ist für das Schwein essentiell, da es nur sehr stark eingeschränkt durch Schwitzen oder die Erhöhung der Atemfrequenz die Körpertemperatur regulieren kann. Dazu kommt, dass Schweine häufig in kleineren Mengen trinken und sich in reizarmen Buchten auch damit beschäftigen, wodurch der Wasserverbrauch steigt. Die Wasserversorgung ist auch unter kalten Temperaturen sicherzustellen, Maßnahmen zum Frostschutz sind dem DLG-Merkblatt 351 zu entnehmen (DLG, 2008).
3. Futter- und Fütterungshygiene
… „spiegelt“ sich u. a. in Futterakzeptanz, -bekömmlichkeit und Wohlbefinden wider …, denn „der Geruch, das Anwühlen, das Auge, der Geschmack (fr)essen mit“
Bei dieser Betrachtungsweise hat und gewinnt die Erreichung bzw. Stabilisierung eines hohen Hygienestatus im Futter selbst und natürlich auch in den Fütterungsanlagen eine genauso hohe Bedeutung, wie die hinreichend und exakte Nähr-, Mineral- und Wirkstoffversorgung der Tiere.
Im Folgenden werden verschiedene Kriterien zur Beurteilung des Hygienestatus im Futter bzw. in Fütterungseinrichtungen erklärt sowie Maßnahmen zur Erreichung gewünschten Hygienestandards erläutert.
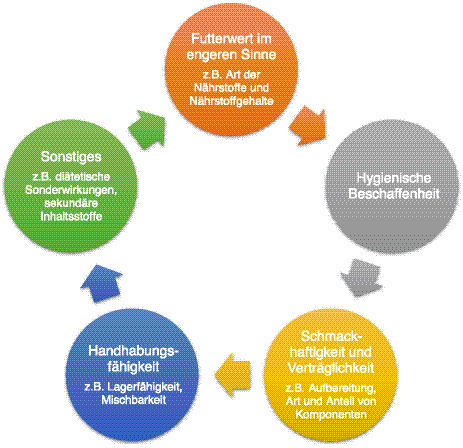
Für die Beurteilung des Hygienestatus in Futter und Fütterung können eine ganze Reihe von Kriterien herangezogen werden. Diese reichen von Verunreinigungen des Futters mit Sand, Erde, Spreu, Keimlingen, Nagerkot usw. sowie Mutterkorn-, Unkrautsamen-, Vorratsschädlingsbesatz, Anteil geschädigter Körner, Mikroorganismen bis hin zu deren Toxinen.
Ein Teil dieser Faktoren (Abbildung 2) lässt sich durch sensorische Prüfungen – Befühlen, Betrachten, Riechen, Schmecken – begutachten. Ergeben sich bei der sensorischen Prüfung Hinweise auf Verderb, sind zur Absicherung weitere Laboruntersuchungen zu empfehlen. Dabei sollte in erster Linie mikrobiologisch auf lebende Mikroorganismen geprüft werden, was bei Verdacht auf Hygienemängel i. d. R. eine sichere Einstufung ermöglicht. Ergänzend kann eine mikroskopische Analyse sinnvoll sein, da evtl. durch bereits fortgeschrittenen Verderb Mikroorganismen abgestorben sind und durch die mikrobiologische Untersuchung dann nicht mehr nachgewiesen werden können.
Für die Beurteilung von Laborergebnissen zur mikrobiologisch-hygienischen Beschaffenheit von Futtermitteln existieren Orientierungswerte (VDLUFA, 2012; VDLUFA, 2017; VDLUFA, 2021). Sie orientieren sich einerseits an produkttypischen Größenordnungen für verschiedene Futtermittel sowie Behandlungs- und Fütterungsverfahren. Keinesfalls besitzen sie die Eigenschaft eines gesetzlich festgelegten Grenzwertes, für den andere Risikomanagementmaßnahmen im Hinblick auf die Verwendungs- und Verkehrsfähigkeit anzuwenden wären (z. B. Verwerfen des kontaminierten Futtermittels).
Ursachen und Folgen mangelnder Futtermittelhygiene
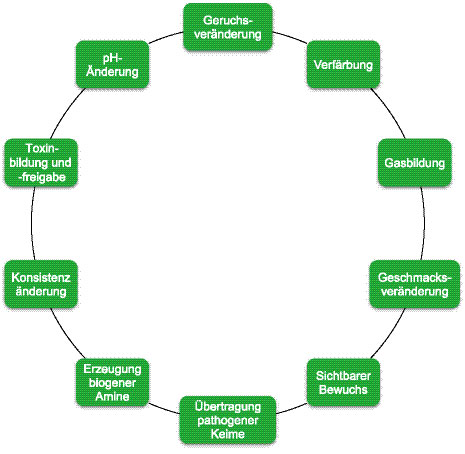
Die möglichen Folgen einer mangelhaften Konservierung, Lagerung, Aufbereitung und Fütterungshygiene sind in Abbildung 3 aufgelistet. Diese können bei einer sensorischen Überprüfung meistens schon gut erkannt werden. Zu den verursachenden Mikroorganismen zählen Schimmelpilze, Hefen (Sprosspilze) und Bakterien. Bezüglich ihrer Wirkungen beim Tier sollten diese Mikroorganismen allerdings differenziert betrachtet werden. Mangelnde Hygiene kann zu einer schlechten Akzeptanz und darüber hinaus auch zu Dysbiosen bis hin zu Verlusten durch Vergiftungserscheinungen oder Aufgasungen im Magen-Darm-Trakt führen. Eine dahingehende Beeinträchtigung der Tiere ist unbedingt zu vermeiden.
Die Reduzierung unerwünschter Keime im Futter muss durch eine intensive Aufbereitung der Rohwaren während der Ernte, z. B. durch Absieben des Getreides vor Einlagerung in die Silos, erfolgen. Ein weiterer Schritt ist eine weitere mechanische Bearbeitung von Getreide vor der Mühle, z. B. durch teilweises Entfernen der Samenschalen als Hauptsitz der schädlichen Keime. Ein weiterer Aspekt der Gesunderhaltung von Rohwaren ist die sachgerechte Lagerung. Dabei stehen optimale Lagerbedingungen (trocken, kühl, frei von Kondenswasserbildung) im Vordergrund. Die Lagerfähigkeit von Rohwaren kann durch Belüftung, Trocknung und Konservierung weiter verbessert werden.
3.1 Unerwünschte Mikroorganismen
Zu den unerwünschten Mikroorganismen zählen Schimmelpilze, Hefen und Bakterien. Bei den Schimmelpilzen sind Feld- und Lagerpilze zu unterscheiden. Schimmelpilze sind deshalb unerwünscht, weil sie Mykotoxine produzieren, die die Gesundheit, Fruchtbarkeit, das Wohlergehen und die Mastleistungen erheblich beeinträchtigen können. Bei sehr hohen Feuchte- bzw. Wassergehalten, z. B. im Fließfutter, sind vermehrt Hefen nachzuweisen bzw. problematisch, andere unerwünschte Mikroorganismen finden meist an den Wandungen von Bottichen sehr gute Lebensbedingungen. In den kühleren Regionen Europas und Nordamerikas stellen die Feldpilze und deren Toxine vielfach ein höheres Belastungspotential als die Toxine der Lagerpilze dar. Von den über 500 bekannten Toxinen bereiten in Europa die von Feldpilzen stammenden Leitmykotoxine Deoxynivalenol (auch Vomitoxin genannt, kurz DON) und Zearalenon (ZEA) je nach Wachstums- und Erntebedingungen in verschiedenen Regionen größere Probleme. Die Lagerbedingungen haben ebenfalls einen Einfluss auf die weitere Futterqualität und sind im Futterhygienecheck zu kontrollieren.
Eine besondere Beachtung benötigen Zuchtläufer und Jungsauen, die, wenn sie mit zu hohen Mengen an mit Zearalenon belastetem Futter versorgt werden, Störungen im Östrogenhaushalt entwickeln können.
Erwähnt werden muss in diesem Zusammenhang auch das Mutterkorn, das hinsichtlich vermehrt zu erwartender Trockenheit und demzufolge eher steigendem Roggen- und Triticaleanbau mit seinen giftigen sogenannten Ergotalkaloiden bei Tier und Mensch unerwünschte gesundheitliche Effekte auslösen kann.
In der ausgesprochen vielfältigen Gruppe der Hefen (= Sprosspilze) sollte zwischen unterschiedlichen Arten differenziert werden. Hier sind besonders die stark CO2-bildenden Arten unerwünscht. Sie finden im Fließfutter und bei feuchten Komponenten optimale Lebensbedingungen. Sie besitzen zudem eine große Toleranz für niedrige pH-Werte. Hefen bauen leicht lösliche Kohlenhydrate wie Zucker und Stärke zu Alkohol, CO2 und Wasser ab. Dies kann zu sehr hohen Trockensubstanzverlusten von bis zu 50 % führen. Gashaltiger Futterbrei führt zu Darmbelastungen mit Verdauungsstörungen, Aufgasen, Darmverschlingungen sowie geringeren Futteraufnahmen.
Futterverderb fördernde Bakterien vermehren sich unter bestimmten Bedingungen (vor allem Feuchte) viel schneller als Schimmelpilze und Hefen. Sie vermehren sich besonders bei hohem Wassergehalt, moderaten Temperaturen und nicht zu niedrigem pH-Wert (> pH 5). Auf jeden Fall unerwünscht sind u. a. Enterobakterien, E-Coli, Salmonellen Listerien und Clostridien. Diese eigentlichen „Darmbewohner“ bauen Eiweiße zu Ammoniak und vielfach schädlichen Stoffen wie z. B. Toxinen ab. Unter den genannten ungünstigen Bedingungen können bestimmte Aminosäuren wie z. B. Histidin zu biogenen Aminen wie Histamin abgebaut werden. Dies führt meist schon im Futter zu Geruchs- und Geschmacksveränderungen und verursacht als erstes einen Rückgang der Futteraufnahmen. Erhöhte Keimzahlen können zu schweren Durchfällen führen.
Milchsäurebakterien zählen in der Regel zu den erwünschten Mikroorganismen, weil sie u. a. die Futterakzeptanz bzw. -aufnahme fördern. In Tabelle 4 sind mögliche Auswirkungen von Mikroorganismen im Futter zusammengestellt.
Tabelle 4: Mögliche Auswirkungen von Mikroorganismen im Futter auf die Verdauungsvorgänge beim Schwein
| Mikroorganismen | mögliche Auswirkungen auf |
| Hefen | Zucker-/Stärkeabbau, Gasbildung, TM-Verluste |
| Schimmelpilze | Zellulose-/Eiweißabbau, Toxinbildung |
| Bakterien (verderbanzeigende) | Eiweißabbau, Toxinbildung |
| Milchsäurebakterien | i. d. R. stabilisierend, fördern den Futterverzehr |
Zucker- und Stärke werden von allen Mikroorganismen abgebaut
3.2 Beurteilung der mikrobiologisch-hygienischen Beschaffenheit von Futtermitteln
Die Beurteilung der mikrobiologisch-hygienischen Beschaffenheit von Futtermitteln stützt sich auf die nachgewiesenen Gehalte an aeroben mesophilen Bakterien, Schimmelpilzen und Hefen und orientiert sich an mikrobiologischen Erfahrungs- bzw. Orientierungswerten (VDLUFA, 2012; VDLUFA, 2017). Dabei versteht man unter einem Orientierungswert die Anzahl Kolonie-Bildender Einheiten je Gramm (KBE/g) an produkttypischen und verderbanzeigenden Keimen, die für das jeweilige Futtermittel bei normaler Beschaffenheit und Unverdorbenheit noch vertretbar ist. Die Keimgehalte geben ausschließlich die Anzahl der noch vermehrungsfähigen Keime wieder, nicht (mehr) vermehrungsfähige oder abgestorbene Keime werden hier nicht erfasst. Orientierungswerte (OW) dürfen nicht als feste Grenzwerte, d. h. futtermittelrechtlich festgelegte obere Begrenzungen bzw. Höchstgehalte, interpretiert werden.
Höhere Keimgehalte müssen nicht zwangsläufig eine Fütterungsuntauglichkeit zur Folge haben. In die abschließende Aussage zur Beurteilung eines Fütterungssystems sind noch weitere äußere Einflussfaktoren (z. B. Stallhygiene) einzubeziehen, die zusätzlich über den betrieblichen Erfolg oder Misserfolg der Nutztierhaltung entscheiden.
Die Erfassung des Keimgehaltes erfolgt durch die Beurteilung von sieben verschiedenen Indikator-Keim-Gruppen (KG), die in der Tabelle 6 aufgeführt sind. Als Beurteilungsmaßstab der mikrobiologisch-hygienischen Beschaffenheit einer jeden Keimgruppe dient letztlich die Keimzahlstufe (KZS, Tabelle 5), die wie folgt Verwendung findet:
Die Gesamtbeurteilung der mikrobiologischen Futterqualität in Form einer Qualitätsstufe (QS) von QS I bis QS IV erfolgt in Anlehnung an die jeweils höchste Keimzahlstufe innerhalb der einzelnen Keimgruppen (KG 1 bis KG 7).
Die einzelnen Informationen zur Beurteilung der mikrobiologisch-hygienischen Beschaffenheit sowie zu Orientierungs- und Richtwerten sind den Tabellen 5 bis 10 zu entnehmen.
Tabelle 5: Keimzahlstufen zur Beurteilung der mikrobiologisch-hygienischen Beschaffenheit der Futterqualität
| Keimzahlstufe (KZS) | Der Keimgehalt einer KG überschreitet... | Bewertung der Qualität |
| KZS I | den Orientierungswert (OW) nicht | normal |
| KZS II | den OW bis zum 5-fachen (in der Regel) | geringgradig herabgesetzt |
| KZS III | den OW bis zum 10-fachen | herabgesetzt |
| KZS IV | den OW um mehr als das 10-fache | verdorben |
Tabelle 6: Beurteilung der mikrobiologisch-hygienischen Beschaffenheit nach Keimgruppen (nach VDLUFA, 2012)
| Bakterien (aerob mesophil) | produkttypisch/ feldbürtig | KG 1 | Gelbkeime, Pseudomonas, Enterobacteriaceae und sonstige Bakterien (z. B. coryneforme Bakterien) |
| verderbanzeigend | KG 2 | Bacillus, Micrococcus und Staphylococcus | |
| KG 3 | Streptomyzeten | ||
| Schimmel- und Schwärzepilze | produkttypisch/ feldbürtig | KG 4 | Schwärzepilze, Acremonium, Verticillium, Fusarium, Aureobasidium und sonstige Pilze (z. B. Trichothecium) |
| verderbanzeigend (Lagerpilze) | KG 5 | Aspergillus, Penicillium, Scopulariopsis, Wallemia und sonstige Pilze (z. B. Paecilomyces) | |
| KG 6 | Mucorales | ||
| Hefen | Produkttypisch/ verderbanzeigend | KG 7 | Hefen aller Gattungen |
Tabelle 7: Ausgewählte Orientierungswerte zur Beurteilung der hygienischen Qualität verschiedener Futtermittel beim Schwein (nach VDLUFA 2017)
| Keimgruppe | KG 1 | KG 2 | KG 3 | KG 4 | KG 5 | KG 6 | KG 7 |
| I. Einzelfuttermittel: | Bakterien produkt- typisch Mio. KBE/g | Bakterien verderb- anzeigend Mio. KBE/g | Streptomyzeten Mio. KBE/g | Feldpilze produkt- typisch Tsd. KBE/g | Lagerpilze verderb- anzeigend Tsd. KBE/g | Mucorales Tsd. KBE/g | Hefen Tsd. KBE/g |
| Getreide (Körner/Schrote) • Mais • Weizen/Roggen/Triticale • Gerste • Hafer | 21 51 201 501 | 0,5 0,5 1 1 | 0,05 0,05 0,05 0,05 | 201 301 401 2001 | 30 20 30 50 | 5 2 2 2 | 601 301 1001 2001 |
| Kleien (Weizen/Roggen) | 8 | 1 | 0,1 | 50 | 50 | 2 | 80 |
| Nachmehle/Grießkleien | 5 | 1 | 0,1 | 50 | 30 | 2 | 50 |
| Extraktionsschrote | 0,5 | 1 | 0,05 | 5 | 15 | 1 | 10 |
| Erbsen und Bohnen | 1 | 0,1 | 0,05 | 10 | 20 | 5 | 20 |
| Rapssaat | 10 | 1 | 0,01 | 50 | 5 | 2 | 0 |
| Heu | 301 | 2 | 0,15 | 2001 | 100 | 5 | 1501 |
| Stroh | 1001 | 2 | 0,15 | 2001 | 100 | 5 | 4001 |
| II. Mischfuttermittel: | |||||||
| Mehlförmig • Mast-/Zuchtschweine • Ferkel • Milchkühe/Mastrinder • Kälber • Legehennen/Mastgeflügel | 6 5 10 2 5 / 3 | 1 0,5 1 0,5 1 / 0,5 | 0,1 0,1 0,1 0,1 0,1 | 50 30 50 30 50 / 30 | 50 20 50 20 50 / 20 | 5 5 5 5 5 | 80 50 80 50 50 |
| Gepresst • Mast-/Zuchtschweine • Ferkel • Milchkühe/Mastrinder • Kälber4 • Legehennen / Mastgeflügel • Pferde • Schafe und Ziegen | 1 0,5 1 0,3 0,5 0,5 0,4 | 0,5 0,1 0,5 0,2 0,5 / 0,1 0,5 0,2 | 0,05 0,05 0,05 0,01 0,05 0,01 0,01 | 5 5 5 2 5 2 2 |
| 1 1 1 1 1 1 1 | 5 5 5 5 5 5 1 |
| Eiweißkonzentrate | 1 | 1 | 0,05 | 10 | 20 | 1 | 30 |
| Milchaustauschfutter | 0,5 | 0,1 | 0,01 | 5 | 5 | 1 | 10 |
| III. Gärfuttermittel: | |||||||
| Maissilage2 | 0,4 | 0,2 | 0,03 | 5 | 5 | 5 | 1.000 |
| Grassilage2, 3 | 0,2 | 0,2 | 0,01 | 5 | 5 | 5 | 200 |
| Biertreber, frisch | 0,5 | 0,3 | 0,01 | 2 | 2 | 1 | 500 |
1 Erntefrische Produkte können wesentlich höhere Keimgehalte aufweisen.
2 Die Mikroorganismen der KG 1 und 4 sind feldbürtig und somit typisch für das Pflanzmaterial vor der Silierung; sie sterben unter optimalen Silierbedingungen ab.
3 Silierprodukte, vorwiegend bestehend aus Gramineen-Arten.
4 Müslis können nach den Orientierungswerten von gepressten Mischfuttermitteln beurteilt werden, sofern sie keine unbehandelten Bestandteile wie Getreide oder Kleien enthalten.
Tabelle 8: Vorläufige Orientierungswerte zur hygienischen Futterbeschaffenheit von Flüssigfutter und Maiskornsilage (Corn-Cob-Mix, CCM) (nach Fachgruppe VI des VDLUFA, 2021#; Stalljohann et al., 2020*)
| Keimgruppe | KG 1 | KG 2 | KG 3 | KG 4 | KG 5 | KG 6 | KG 7 |
| IV. Sonstige Futtermittel: | Bakterien ohne Milchsäurebakterien Mio. KBE/g | Schimmelpilze Feld- und Lagerpilze Tsd. KBE/g | Hefen Tsd. KBE/g | ||||
| Flüssigfutter# | 8 | 0,1 | 0,02 | 5 | 5 | 1 | 1.000 |
| Maiskornsilage* | 0,10 | 0,50 | 100 | ||||
* Werte der LUFA Nordrhein-Westfalen, Münster (Stalljohann et al., 2020)
Tabelle 9: Orientierungswerte zu Höchstgehalten an Mykotoxinen in der EU in Futtermitteln für Schweine (EU, 2016)
| Mykotoxin | Zur Fütterung bestimmte Erzeugnisse | mg/kg (ppm) Futter mit 88 % TM |
| Deoxynivalenol (DON) | Getreide und Getreideerzeugnisse* Maisnebenprodukte Ergänzungs- und Alleinfuttermittel | 8 12 0,9 |
| Zearalenon (ZEA) | Getreide und Getreideerzeugnisse* Maisnebenprodukte Ergänzungs- und Alleinfuttermittel • für Ferkel und Jungsauen • für Sauen und Mastschweine | 2 3 0,1 0,25 |
| Ochratoxin A | Getreide und Getreideerzeugnisse* Ergänzungs- und Alleinfuttermittel | 0,25 0,05 |
| Fumonisin B1 + B2 | Mais- und Maiserzeugnisse** Ergänzungs- und Alleinfuttermittel | 60 5 |
* umfasst auch Getreidegrünfutter bzw. -grobfutter (GPS)
** umfasst auch Maisgrünfutter bzw. -grobfutter (Maiskornsilage, Maissilage)
Tabelle 10: Futtermittelrechtlicher Höchstgehalt an Mutterkorn in Futtermitteln für Schweine (EU, 2002)
| Mykotoxin | Zur Fütterung bestimmte Erzeugnisse | mg/kg (ppm) Futter mit 88 % TM |
| Mutterkorn* | Futtermittel-Ausgangserzeugnisse und Mischfuttermittel, die ungemahlenes Getreide enthalten | 1.000 (Absenkung auf 500 vorgesehen) |
* Planung der Einführung der direkten Untersuchung auf Ergotalkaloide
Auf EU-Ebene wird derzeit eine Neuregelung der Mykotoxine diskutiert. Dies kann bedeuten, dass gegenwärtige Richtwerte und Höchstgehalte aktualisiert und weitere Einzelfuttermittel in die Regelung einbezogen werden. Für Einzelfuttermittel sollen demnach weiterhin Richtwerte gelten, bei Alleinfuttermitteln wird die Einführung von Höchstgehalten unter Berücksichtigung der Empfindlichkeit der Tierart gegenüber dem spezifischen Mykotoxin erwogen. Darüber hinaus ist bei Mutterkorn neben der möglichen Absenkung des Höchstgehaltes auf 500 ppm die Einführung der Untersuchung auf Ergotalkaloide anstelle der indirekten Bestimmung über die Mutterkorn-Sklerotien nach einer mehrjährigen Übergangsphase geplant. Die möglichen Anpassungen sind nach deren Veröffentlichung zu berücksichtigen.
Neuere Analysenmethoden (z. B. Multimethoden und Schnelltests) können sicherlich schnelle Ergebnisse liefern, sollten aber v. a. in ihren Einführungsphasen im Rahmen einer sorgfältigen Qualitätssicherung kritisch geprüft werden. Wenn möglich sollte eine Normierung neuer Nachweisverfahren erfolgen.
Hohe Futter- und Fütterungshygiene erreichen und stabilisieren erfordert:
- Gezielte acker- und pflanzenbauliche Maßnahmen wie u. a. Fruchtfolge (insbesondere bei Maisanbau), Bodenbearbeitung, Sortenwahl, Düngung und Pflanzenschutz, Reife- und witterungsoptimiertes Ernten, zügiges Konservieren, Technik sowie futterabhängiges, sachgerechtes Lagern
- ein gezieltes Controlling der Maßnahmen ist zu empfehlen
- Stete Begleitung mit einem Hygienecheck
3.3 Empfehlungen zur Konservierung von Getreide
Durch eine abgestimmte Wahl von Erntezeitpunkt und Konservierungsverfahren lässt sich die Futterqualität am weitreichendsten sichern und positiv beeinflussen. Immer wieder wird die Entscheidung zwischen Erreichen eines optimalen Abreifegrades und dem möglichen zukünftigen Wetterrisiko abverlangt. Sowohl ein zu früher als auch ein zu später Erntetermin wirken sich ungünstig aus. Auf jeden Fall müssen den Feld- und Lagermikroorganismen schnellstmöglich die Lebensbedingungen entzogen werden. Bekanntlich beginnt dieses bereits beim Einstellen der Erntemaschinen. Der Bruchkornanteil sollte auf jeden Fall unter 2 % liegen, da sonst die freiliegende Stärke der Körner eine hervorragende Nahrungsquelle für Mikroorganismen bildet. Je höher dieser Anteil, desto schneller und intensiver ist zu konservieren.
Für eine erfolgreiche Konservierung können verschiedene Verfahren genutzt werden. Alt bekannt ist die rasche Trocknung auf ≤ 14 % Restfeuchte, das Kühlen und zunehmend der Säurezusatz auf intakte Körner. Entscheidend ist bei allen Verfahren, dass ein gleichbleibender Hygienestatus im Endlager erreicht wird. Vor der Konservierung sollte sehr genau geprüft werden, ob auf eine Reinigung des Erntegutes verzichtet werden kann. Die Anschaffung und Inbetriebnahme eines schlagkräftigen Windsichters erhöht auf jeden Fall die Sicherheit für eine bessere Konservierung. Beim Einsatz von Säuren wird dadurch auch die Effektivität gefördert, weil die Benetzung von Spreu und Staub unterbleibt und damit für die Körnerbenetzung mehr zur Verfügung steht. Weitere Informationen zur Dosierung von Säuren etc. sind im Praxishandbuch Futter- und Substratkonservierung nachzulesen (DLG, 2011)
3.4 Empfehlungen zur Konservierung von Mais
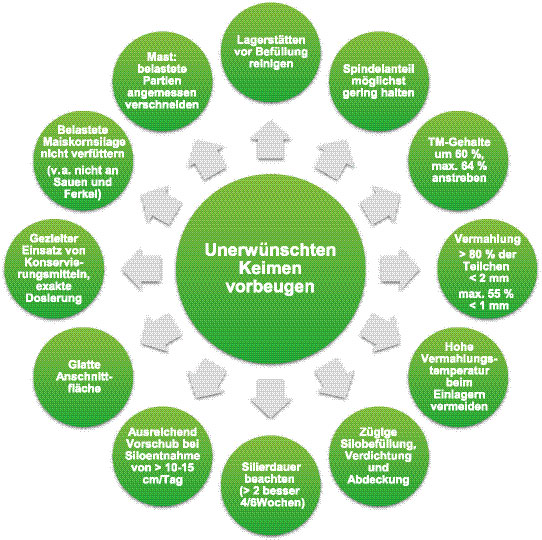
Ein Maßnahmenkatalog mit Empfehlungen zur Bereitstellung von hygienisch hochwertiger Maiskornsilage (in einigen Regionen als auch Corn-Cob-Mix (CCM) bezeichnet) sollte alljährlich checklistenmäßig abgefragt und umgesetzt werden. In der Abbildung 4 sind in einem „Karussell“ die wichtigsten Maßnahmen zusammengefasst. Oberstes Ziel bei allen alljährlichen Maßnahmen bei der Gewinnung von Maiskornsilage ist es, einen schädlichen Gehalt an Keimen möglichst gering zu halten und die Milchsäurebildung zur stabilen Konservierung zu fördern.
Für einen stabilen Ablauf der Milchsäuregärung sollte der TM-Gehalt der Maiskörner kleiner als 65 % sein und der Milchsäuregehalt mindestens 1,8 % betragen. Die Öffnung des Flachsilos sollte frühestens nach 4 bis 6 Wochen erfolgen, ein Konservierungszusatz kann einen früheren Fütterungsstart, z. B. nach bereits 2 Wochen, zulassen.
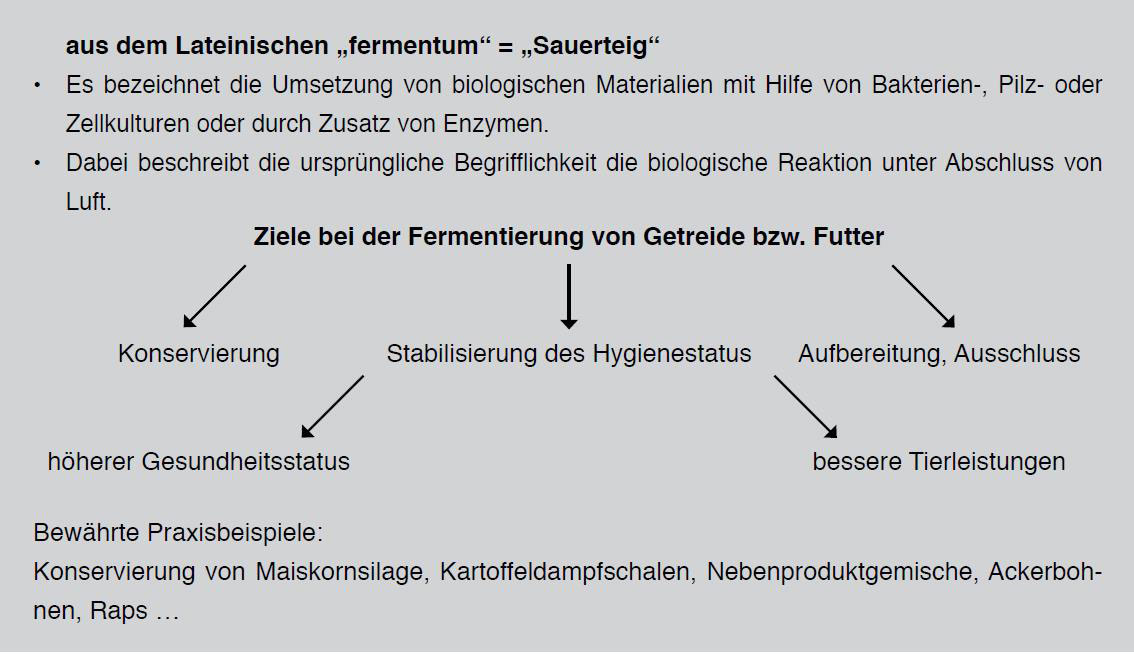
3.5 Behandlung und Fermentation
Die Fermentierung dient zur Verbesserung der Verwertbarkeit, Verträglichkeit und insbesondere zur Haltbarmachung gerade von leicht verderblichen Futtermitteln und ist ein seit Langem genutztes und bewährtes Verfahren. In der modernen Schweinefütterung spielt die Fermentation vor allem zur Steigerung der Verdaulichkeit und damit verbunden zur Verbesserung der Futter- und Resourceneffizienz für mehr Nachhaltigkeit eine herausragende und immer bedeutender werdende Rolle. Ein weiterer Aspekt gilt den positiven Wirkungen hinsichtlich einer verbesserten Darmgesundheit und damit verbunden einem vermutlich intakteren Immunsystem. Hierüber ist eine positive Beeinflussung des Verhaltens der Tiere denkbar.
Während bei der Nahrungsmittelaufbereitung, z. B. bei der Sauerkrautherstellung, noch oft Verfahren mit natürlich beginnenden Fermentationsprozessen (über den epiphytischen, natürlichen Keimbesatz) angewendet werden, werden in der Futterfermentation fast ausschließlich Verfahren mit einem gezielten Zusatz von Bakterienstämmen (Starterkulturen auf Basis von Milchsäurebakterien) genutzt. Damit wird eine von Anfang an gerichtete Fermentation mit einer bevorzugten, wenig energieverbrauchenden Milchsäuregärung sichergestellt und Fermentationsschädlingen (bestimmte Bakterien, Hefen, Schimmelpilze) werden schnell Lebensgrundlagen entzogen bzw. in ihrer Vermehrung gehemmt. Neben heterofermentativen Milchsäurebakterien kann die Zugabe von organischen Säuren (z. B. Propionsäure u. a.) bzw. deren Salzverbindungen ebenso zur Verbesserung der Futterhygiene des Gärfutters beitragen. Richtige Dosierung und optimale Verteilung von Additiven, welche die aerobe Stabilität verbessern (Produkte mit DLG-Gütezeichen der Wirkungsrichtung 2), sind Voraussetzung für den Gärerfolg (DLG, 2011).
Derzeitige Forschungsaktivitäten und praktische Erprobungen in der Fütterung landwirtschaftlicher Nutztiere mit einhöhligen Mägen erfolgen deshalb i. d. R. mit dem Zusatz von Milchsäurebildnern unter Einhaltung bestimmter Temperaturen, Zeiten, Wasserqualitäten sowie Rühr- und Mischtechniken. Die Fütterungsempfehlungen zur Herstellung von Fermentationslösungen und deren Mischungen mit unbehandelten Futtern erfolgen deshalb vorwiegend für die sogenannte kontrollierte Fermentation.
Grundsätzliche Empfehlungen zur Fermentierung

3.6 Haltbarkeit von fertigen Mischungen
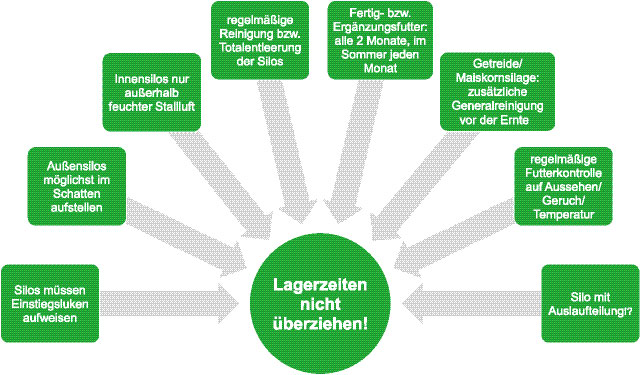
Bei der Vorlagerung von vermahlenen Komponenten und Futtermischungen sollten zur Vermeidung einer stärker einsetzenden Mikroorganismenvermehrung bestimmte Lagerzeiten nicht überschritten werden. In der Übersicht sind die empfohlenen Lagerzeiten aufgelistet.
Tabelle 11: Orientierungswerte zur optimalen Lagerdauer von Futtermitteln
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
➝ Vorratsschädlinge bekämpfen!
Neben mangelnder Konservierung und Verarbeitung betriebseigener und zugekaufter Futtermittel führen Vorratsschädlinge zu einem schnellen Verderb von Futter. In Tabelle 12 sind häufig vorkommende Vorratsschädlinge mit ihren Schadbildern, Folgen und ihrer Vorbeuge aufgeführt.
Tabelle 12: Vorratsschädlinge
| Schadensbild(er) | Folgen | Vorbeugung | |
| Nager, Vögel | Verunreinigungen (Kot, Harn, Kadaver) | übertragen Krankheiten, Salmonellen | Abdeckungen, Netze, Fallen, Giftköderkisten |
| Käfer (Korn-, Getreideplattkäfer) | an-/ausgehöhlter Körner | Gewichtsverluste, Pilzwachstum | regelmäßig reinigen, Totalentleerungen der Silos/Lagerstätten |
| Motten (Mehl-, Speichermotte) | Spinnfäden auf dem Getreide | Kondensation, Pilzwachstum | s. o. |
| Milben | bei > 65 % Luftfeuchte: Getreidefraß/-zerkleinerung | allergische Reaktionen, Pilzwachstum | s. o. |
4. Fazit
Die Basis für eine erfolgreiche Tierhaltung wird durch eine hohe Wasserqualität und -hygiene neben hygienisch einwandfreien Einzelkomponenten gelegt. Dies stellt die Basis für die dem Tier vorgelegten (im Teil A beschriebenen) Futtermischungen (Selbstmischer und Mischfuttermittel) dar. Ein derartiges Vorgehen wirkt sich erfahrungsgemäß positiv auf das Tierwohl aus.
Aus diesem Grund sollten alle Maßnahmen, von der Gewinnung bis zur Bereitstellung von Wasser und Futter, durch ein regelmäßiges Controlling stets kritisch begleitet werden. Denn nur die komplette Optimierung dieser „Lieferketten“ kann eine hygienisch einwandfreie Versorgung der Tiere sicherstellen. Dazu stehen bewährte und erprobte Untersuchungsmethoden und Bewertungsschemata für die Wasserqualität und die Futterbeschaffenheit zur Verfügung.
5. Quellen
- BMELV (2007): Orientierungsrahmen zur futtermittelrechtlichen Beurteilung der hygienischen Qualität von Tränkwasser. Stand: 25. Mai 2007.
- BMEL (2019): Hygienische Qualität von Tränkwasser: Orientierungsrahmen zur futtermittelrechtlichen Beurteilung. Stand: 19. Juli 2019. www.bmel.de/DE/themen/tiere/futtermittel/orientierungsrahmen-traenkwasser.html
- Cole et al. (1993): Recent Developments in Pig Nutrition 2, Nottingham University Press, 374 Seiten.
- DLG (2008): Tränketechnik für Schweine. DLG-Merkblatt 351, Frankfurt a.M.
- DLG (2021): Fütterung und Tierwohl beim Schwein – Teil A: Futter, Fütterung und Faserstoffversorgung. DLG-Merkblatt 463, Frankfurt a.M.
- EU (2002): Richtlinie 2002/32/EG des Europäischen Parlaments und des Rates vom 07.05.2002 über unerwünschte Stoffe in der Tierernährung.
- EU (2016): Empfehlung 2016/1319/EG vom 29.07.2016 zur Änderung der Empfehlung 2006/576/EG der Kommission vom 17.08.2006 betreffend das Vorhandensein von Deoxynivalenol, Zearalenon, Ochratroxin A, T-2- und HT-2-Toxin sowie von Fumonisinen in zur Verfütterung an Tiere bestimmten Erzeugnissen.
- Kamphues et al. (2007): Empfehlungen zur Beurteilung der hygienischen Qualität von Tränkwasser für Lebensmittel liefernde Tiere unter Berücksichtigung der gegebenen rechtlichen Rahmenbedingungen. Landbauforschung Völkenrode, 57, 255–272.
- KTBL (2009): Wasserversorgung in der Schweinehaltung: Wasserbedarf – Technik – Management. KTBL-Heft 82, Darmstadt.
- Stalljohann et al. (2020): Rechenmeister für eine effizientere Schweinefütterung. Landwirtschaftskammer Nordrhein-Westfalen (Hrsg.), Neuauflage 2020, Landwirtschaftsverlag Münster-Hiltrup.
- VDLUFA (2012): Bestimmung der Keimgehalte an Bakterien, Hefen, Schimmel- und Schwärzepilzen. In: Handbuch der Landwirtschaftlichen Versuchs- und Untersuchungsmethodik (VDLUFA-Methodenbuch), Bd. III, Die chemische Untersuchung von Futtermitteln, Methode 28.1.2, 8. Ergänzungslieferung 2012. Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten (Hrsg.), VDLUFA-Verlag, Darmstadt.
- VDLUFA (2017): Verfahrensanweisung zur mikrobiologischen Qualitätsbeurteilung. In: Handbuch der Landwirtschaftlichen Versuchs- und Untersuchungsmethodik (VDLUFA-Methodenbuch), Bd. III, Die chemische Untersuchung von Futtermitteln, Methode 28.1.4. Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten (Hrsg.), VDLUFA-Verlag, Darmstadt.
- VDLUFA (2021): Leitfaden - Ableitung von mikrobiologischen Orientierungswerten bei Futtermitteln. Mitteilung des Arbeitskreises „Futtermittelmikrobiologie“ der FG VI des VDLUFA (Autoren: E. Bucher und W. Wagner)
- Download von VDLUFA-Homepage www.vdlufa.de/de/index.php/fachgruppen-40/fg-vi am 07.06.2021.
Vervielfältigung und Übertragung einzelner Textabschnitte, Zeichnungen oder Bilder (auch für den Zweck der Unterrichtsgestaltung) sowie Bereitstellung des Merkblattes im Ganzen oder in Teilen zur Ansicht oder zum Download durch Dritte nur nach vorheriger Genehmigung durch DLG e.V., Servicebereich Marketing, Eschborner Landstraße 122, 60489 Frankfurt am Main, Tel. +49 69 24788-209, M.Biallowons@DLG.org